- Parasitic Extraction 및 Metal Layer Stack Rc Extrac
- Vlsi Cad Rents Rule이란
- 싱가포르 여행기 뉴턴 맥스웰 호커 푸드 센터
- 내가 보려고 만든 반도체 자료 모음집 반도체 검색 꿀팁
- 2025 신년사 반도체로 빛나는 대한민국의 새 아침
- 과학기술정책 Bio Tech 곧 Gdp 대비 의료비 20 비율의 시대가 옵니다
- 과학기술조직론 과학기술 스타트업 창업 후 운영 방안
- 제 2차 세계대전과 미국의 과학기술 발전 Mit Rad Lab 오펜하이머 Los Alamo
- 과학기술조직론 Team Building
- 부자와 Stem 엘리트들 한국 탈출 이유
- 메리크리스마스 이웃 여러분 모두 감사합니다 100도 인사
- 미국 과학기술 정책 Ffrdc 모델과 Pipeline 모델
- Darpa Defense Advanced Research Projects Agency 미국
- 과학기술 이념 정리 미국은 어떻게 과학기술 강대국이 되었는가
- 과학기술정책 현대 경제성장은 어디에서 올까
- 과학기술정책 과학 기술 차이 발명 혁신 차이
- Vlsi 설계 가이드 Global Routing이란 Detailed Routing이란
- Vlsi Physical Design에서 Routing이란 Global Routing De
- 반도체 설계 검증 Routing Congestion의 Estimation과 Optimiza
- 반도체 산업 서적 추천 현재를 이해하고 미래를 예측하기 위한 반도체 교양필수
- 반도체 엔지니어 커리어 관리 반도체 슈퍼 사이클을 따라서
- 반도체 설계 검증 취업 하는법 조언
- 개발자 엔지니어 선물 추천 Whats On My Desk 내가 엔지니어로써 느끼는 사무실의
- Vlsi Physical Design에서 Power Ring이란 Power Stripe란
- 2024 마이 블로그 리포트 데이터로 찾아보는 내 블로그 마을
- 디지털 반도체 설계 엔지니어들은 회사에서 무엇을 할까
- Vlsi Physical Design에서 Bound란
- Stem Consulting Semiconductor 반도체 취업이직고민 상담 받습니다
- Autodesk 오토캐드 싸게 사용하는법 1999 공유계정
- Auto Pr Placement Blockage란 Vlsi Physical Design
[과학기술정책] Bio-Tech: 곧 GDP 대비 의료비 20% 비율의 시대가 옵니다.
대한민국의 GDP 대비 의료비 “비율”
출처 : No Site
미국의 경우 내년~내후년 정도에 20%찍을 것 같고, 우리나라도 그 속도를 따라 갈 것처럼 보입니다.
여러분의 소득에서 20%가 의료비로 나가는 것이죠. 젊을 때 거의 안 쓰더라도, 나이 먹으면 엄청나게 씁니다.
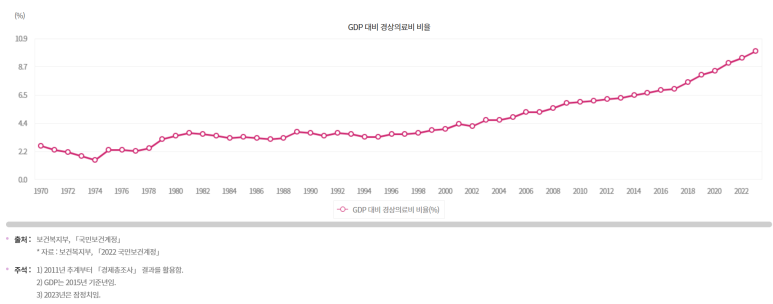
그만큼 의료산업이 큰 산업입니다. 관심을 가져주셔야해요.
미국의 바이오·의약 분야 혁신 사례를 중심으로, NIH(National Institutes of Health, 미국 국립보건원)와 바이오 테크 (생명공학) 산업이 어떻게 작동하는지 살펴보겠습니다.
특히 NIH의 R&D 모델과 제약·바이오텍 업계의 경제 구조, 그리고 FDA(미국 식품의약국) 승인 과정이 어떻게 맞물려 돌아가는지 알아보겠습니다.

NIH: 미국 보건의료 혁신의 중추
1) 역사적 배경
2차 세계대전 전: 초기 NIH는 공중보건국(Public Health Service)에 속한 소규모 연구소였음.
2차 세계대전 중 페니실린 등 의약 혁신이 성공을 거두며 Medical R&D 중요성이 부각되었습니다.
전쟁 후, 과학 정책의 기틀을 잡은 Vannevar Bush와 FranklinD Roosevelt 대통령의 제안으로 ‘질병과의 전쟁’이 선포되었고, 이에 따라 NIH가 점차 규모를 확장하게 되었습니다.
Vannevar Bush의 기본 연구 모델
1950년대에 들어, NSF(국립과학재단)와 함께 NIH 등 여러 과학 기관이 설립·확대되었는데, NIH는 생명과학 분야의 ‘기초연구’를 주도하는 기관으로 자리매김했습니다.
NIH는 기초연구에 집중하기 때문에, 산업과의 연계(기술 상용화)나 타 기관과의 융합 R&D에는 적극적이지 않다는 특징이 있습니다. 예컨대, TonyFauciTony Fauci (NIAID 국장)는 “제품 개발을 위한 경로는 우리의 연구 전략에 포함되지 않는다”라고까지 말했을 정도입니다.
2) NIH의 R&D 투자 규모
NIH는 매년 370억 달러(약 50조 원) 규모의 연구개발(R&D) 예산을 운영합니다.
미국 내 대학 및 연구기관, 그리고 젊은 연구자들을 대상으로 멘토십(mentor-based training) 프로그램을 제공하여, 탄탄한 인력 양성 시스템을 갖추고 있습니다.
이러한 역량을 기반으로 생명과학 분야에서 미국은 여전히 세계적인 선도 지위를 유지하고 있습니다.
바이오 혁신 시스템: 학계·스타트업·벤처 생태계의 결합
1) 강력한 인재 및 지식 생태계
학계와 업계의 경계가 사라짐
기존에는 “학계는 학계, 기업은 기업”이라는 식의 구분이 뚜렷했으나, 바이오 영역에서는 많은 교수가 창업에 참여하거나, 기업에서 근무했다가 다시 대학으로 돌아가는 사례가 흔해졌습니다.
이는 NIH가 기초연구에 집중하여 축적한 지식과 인력을, 바이오텍 스타트업들이 적극적으로 활용할 수 있는 길을 열어주었습니다.
초기 투자 유치가 쉬운 이유?
바이오텍 회사들은 신약 후보 물질이 실제 시장에 출시되기 10~15년 전부터 벤처 캐피털(VC) 혹은 IPO(상장)를 통해 대규모 자금을 모읍니다.
이는 특허(IP)의 높은 가치와 FDA 승인 과정에서 얻는 ‘Benchmarking’ 덕분입니다.
2) FDA 승인 프로세스의 역할
3단계 임상시험을 통한 위험도 관리
FDA 임상시험은 1상, 2상, 3상을 거치며, 단계별로 성공·실패 확률이 어느 정도 예측 가능합니다.
각 단계 통과 시점마다 투자자들은 위험도와 향후 가치(ROI)를 비교적 명확하게 산정할 수 있습니다.
기술 검증(technology certification) 효과
FDA 승인을 받으면 전 세계적으로 “이 약은 안전성과 유효성이 입증되었다”라는 인증 효과가 생기므로, 시장 진입이 즉각적으로 가능해집니다.
물리과학이나 반도체 분야에는 이처럼 공신력 있는 ‘기술 인증 기관’이 없기 때문에, 바이오텍 대비 초기 자본 조달이 훨씬 어려운 편입니다.
경제 모델과 ‘Blockbuster medicine’ 문제

1) 블록버스터 의약품 중심의 개발
신약 개발은 보통 10년 이상 소요되며, 임상시험 기간만 7년 정도 걸립니다. 그동안 막대한 비용을 견뎌야 하는 제약·바이오텍 기업들은, 개발비를 회수할 수 있는 대규모 시장 중심으로 움직이게 됩니다.
이는 희귀질환, 제3세계 전염병, 소수 환자 대상의 맞춤형 치료 등 ‘시장성이 부족한’ 영역을 배제하게 만드는 요인이 됩니다.
출처 : No Site
2) 특허 및 독점권
의약품 특허는 보통 출원 후 20년간 보호됩니다. 그러나 실제 판매 허가는 임상시험 이후에나 가능하니, 순수하게 시장에서 독점 가능한 기간은 10년 내외가 됩니다.
그럼에도 불구하고, 시장 진입에 성공하면 독점권을 바탕으로 높은 수익을 기대할 수 있습니다. 이는 앞서 말한 벤처 투자 활성화의 주요 동인입니다.
다가오는 비용 위기와 의료 재정 문제
1) 미국 의료비 지출 폭증
미국의 총 의료비 지출(공공+민간)은 2025년경 GDP(국내총생산)의 20%에 이를 것으로 전망됩니다.
이미 정부가 부담하는 Medicare, Medicade, SSA(사회보장국) 등 비용은 GDP 대비 꾸준히 증가하고 있으며, 정부 예산에서 의료비가 차지하는 비중이 빠르게 확대되고 있습니다.
2) 재정적 지속 가능성 우려
미국 연방정부 재정 수입은 전통적으로 GDP의 18~19% 선에서 머무는 경향이 강합니다.
그러나 의료 관련 지출이 GDP의 20%를 넘어서는 상황이 지속되면, 정부 재정이 감당하기 어려운 수준에 이를 수 있습니다.
결국, 의약 R&D 체계와 의료비용 억제 정책이 균형을 이루지 않으면, 의료 파탄(health care train wreck)이 찾아올 것이라는 우려도 제기됩니다.
출처 : No Site
PCAST(대통령 과학기술자문위원회) 보고서(2012년)의 경고: ‘Eroom’s Law’
2012년, 백악관 직속 대통령 과학기술자문위원회(PCAST, President’s Council of Advisors on Science and Technology)는 “Propelling Innovation in Drug Discovery Development and Evaluation” 보고서를 통해, 미국 바이오·제약 분야의 생산성 둔화와 비용 급증을 지적했습니다.
Eroom’s Law: 신약 개발 비용은 9년마다 2배가 된다.
출처 : No Site

Bridging the preclinical and clinical worlds concepts, Examples, Successes and Failures in Translational Medicine, Attila Seyhan Brown UniversityEroom’s Law(‘무어의 법칙’의 반대 현상)
무어의 법칙(Moore’s Law)은 반도체 성능이 2년마다 2배로 늘어나는 걸 비유합니다.
반면 Eroom’s Law는 신약 개발비가 9년마다 2배로 늘어나면서, 오히려 나온 신약은 줄어드는 현상을 말합니다.
임상시험 비용은 약 18억 달러(1.8 billion)까지 치솟았고, 실패율은 높아졌으며, 제약사들의 특허만료(‘Patent Cliff’)로 인해 R&D 투자 여력이 줄어드는 악순환이 이어진다고 보고서는 지적합니다.
NIH와 FDA 간 협력·도구(tool) 개발 미흡
FDA가 신약을 평가하는 데 필요한 분석기술, 측정도구, 데이터 플랫폼 등이 별도로 개발·지원되지 않고 있습니다.
NIH 입장에서는 “허가·평가”는 FDA 몫이므로 적극 개입하지 않고, FDA 역시 자체 R&D 역량이 부족해 평가 과정이 비효율적으로 길어진다는 문제입니다.
“Bad Bugs, No Drugs”: 항생제 위기의 시대
생명과학 분야에서 “블록버스터 약물”과 “고비용 임상시험” 문제가 주로 언급되지만, 실제로는 항생제 내성(Drug Resistance)이라는 심각한 위협이 병원과 사회 전반에 빠르게 확산되고 있습니다.
감염병학회(Infectious Disease Society of America가 발표한 “Bad Bugs, No Drugs” 보고서와, FDA(미국 식품의약국)의 “Innovation Stagnation” 보고서에서 제기된 항생제 및 의약품 개발 부진 문제를 살펴보고자 합니다.
[여러분, 항생제가 꼭 필요한 것 아니라면… 처방, 투여를 최소화하십시오.]
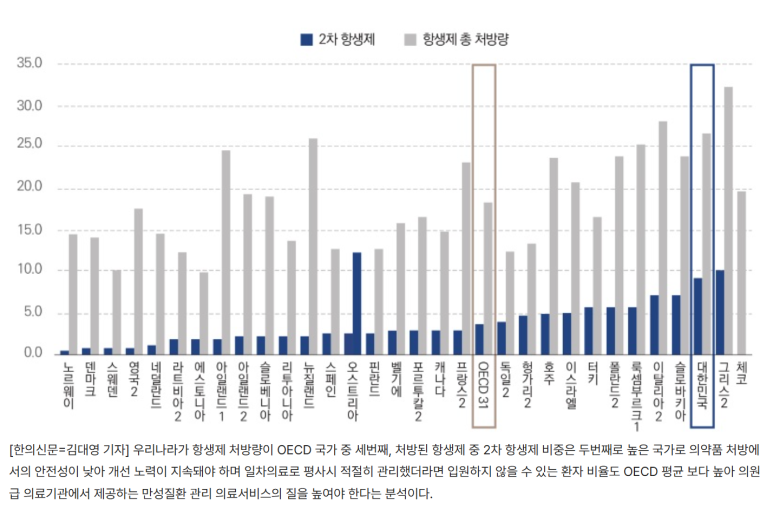
우리나라 항생제 처방량 OECD 중 세번째로 많아, 한의신문 김대영 기자—
- “Bad Bugs, No Drugs”: 항생제 개발 정체와 공중보건 위기
1) 항생제 내성의 심각성
치료 효과 급감: 병원에서 흔히 사용되는 페니실린, 메티실린 등 주요 항생제에 대한 내성이 빠른 속도로 확산되고 있습니다.
치명적 감염 확대: 미국에서만 매년 수백만 명이 병원 내 감염에 노출되며, 수만 명이 사망한다는 통계가 존재합니다.
신약 개발 부족: 지난 30년간 승인된 새로운 항생제(Class)는 단 2가지뿐이고, 그중 하나는 이미 내성이 보고되었습니다.
2) 왜 항생제 연구가 정체됐을까?
제약사는 장기간·고가로 지속 판매 가능한 ‘만성질환 치료제’에 집중합니다.반면, 항생제 치료는 “빨리 완치되는 약”이어서 개발 ROI가 낮습니다.
출처 : No Site
3) 정부·기관의 대응 미흡
FDA·NIH 간 공백: NIH(미국 국립보건원)는 기초연구 위주로 투자하고, FDA는 신약 심사를 담당하지만, 중간단계인 “응용·개발 연구”가 취약합니다.
연구 인프라·도구 부족: 임상시험 간소화, 예측 모델(동물·컴퓨터 모델), 바이오마커 개발 등 적극적인 ‘Applied Science(응용 과학)’가 필요한데, 제대로 지원되지 않고 있습니다.
-> 결국, 의료 제품 개발 속도 둔화, 신뢰할 만한 ‘도구(toolkit)’의 부족 현상 결과가 나옴.
‘항생제 내성’ 시대, 신약개발을 위해 정부는 무엇을 해야 할까?
R&D 경제 모델 재설계
블록버스터 위주 구조를 보완 할 수 있는 과학 기술 정책이 필요.
감염병 등 ‘비(非)블록버스터’ 분야에도 지속적 투자 인센티브를 부여(예: 세액 공제, 특허, 시장 독점권 연장 등).
글로벌 차원에서도 WHO, 국제 공동기금 등을 통한 범국가적 협력이 필요.
여러분은 이에 대해 어떻게 생각하시나요?
해시태그 :